A eficácia a longo prazo do Brintellix® em pacientes com transtorno depressivo maior
Até 1 em cada 4 pacientes que se recuperam de um episódio depressivo maior (EDM) terão recorrência dentro do primeiro ano.2 Além disso, número maior de episódios anteriores, duração maior do episódio depressivo e maior gravidade dos sintomas geralmente são preditivos de recorrências futuras.3
Para prevenir recaídas e recorrências, é recomendado tratamento de longo prazo por pelo menos seis meses após a remissão do episódio depressivo agudo para pacientes com TDM que responderam ao tratamento.3,4
Dados de cinco estudos de longo prazo, abertos e com doses flexíveis, avaliaram se as melhorias nos sintomas depressivos no TDM continuam após o tratamento agudo (seis a oito semanas) com Brintellix®.1
Veja os resultados abaixo.
O Brintellix® (5-20 mg) proporciona melhora sustentada dos sintomas do TDM† a longo prazo.1,5
Alteração na pontuação total da escala MADRS para pacientes previamente tratados com Brintellix® 5-20 mg/dia em estudos controlados (agudos) que continuaram o tratamento em estudos abertos de extensão por 52 semanas.1
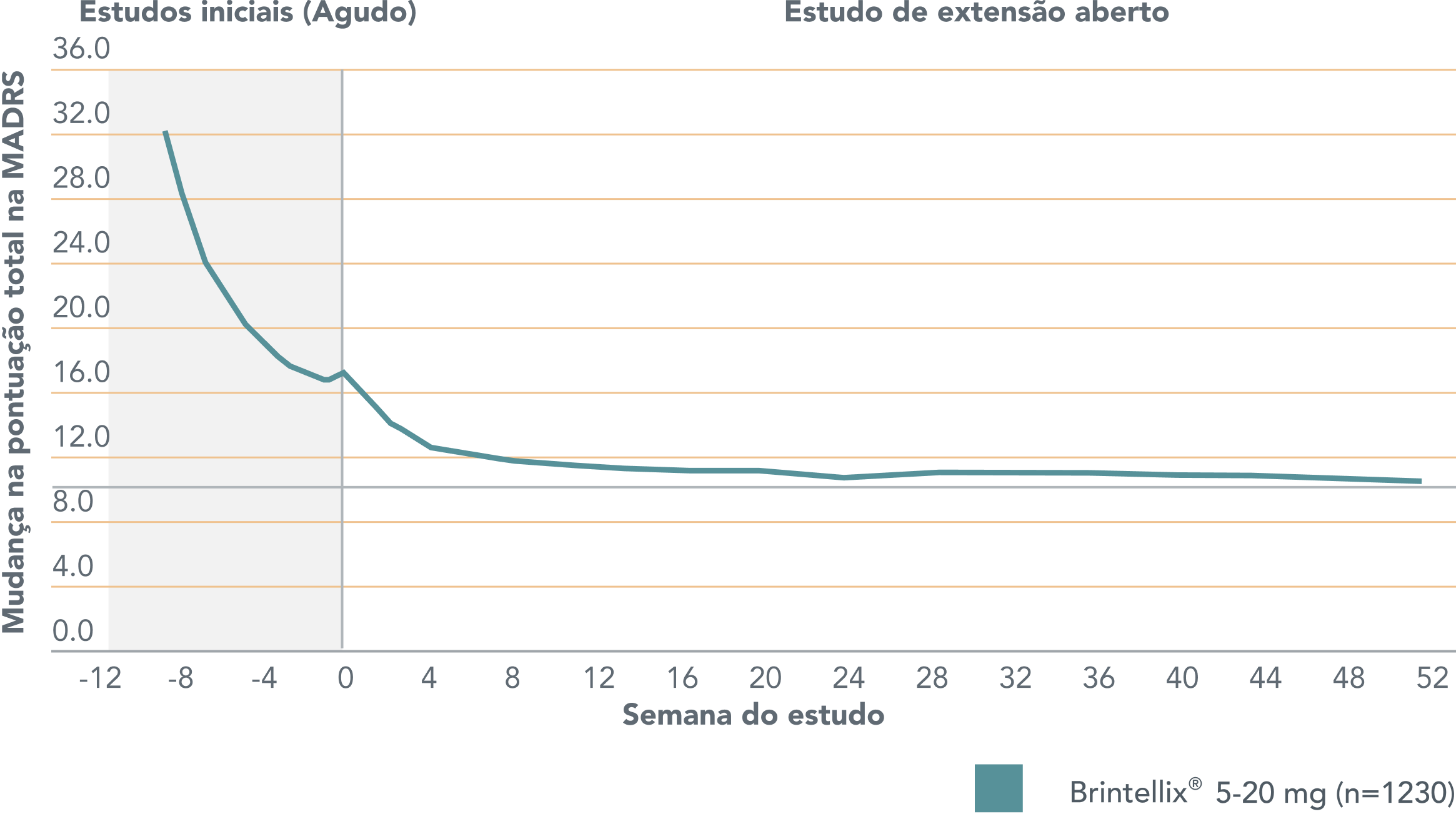
Adaptado de Vieta E et al. 2017.
A linha horizontal cinza indica o ponto de corte para remissão (definida por uma pontuação total na MADRS ≤ 10).
A linha vertical cinza representa o início do tratamento no estudo de extensão (semana 0).
Adaptado de Vieta E et al. 2017.
A linha horizontal cinza indica o ponto de corte para remissão (definida por uma pontuação total na MADRS ≤ 10).
A linha vertical cinza representa o início do tratamento no estudo de extensão (semana 0).
Melhoras nos sintomas do TDM† observadas com Brintellix® durante os estudos de curto prazo (6-8 semanas) continuaram no início do estudo de extensão e foram mantidas com continuamente ao longo de 52 semanas.1

Brintellix® foi geralmente bem tolerado a longo prazo1 e apresentou um perfil de segurança consistente com estudos clínicos anteriores.5,6 O evento adverso emergente do tratamento (TEAE) mais comumente relatado foi náusea (16,6%). Outros TEAEs com uma incidência ≥ 5% incluíram dor de cabeça (12,9%), rinofaringite (9,4%), diarreia (6,4%) e aumento de peso (5,3%).1 A taxa de descontinuação durante a extensão a longo prazo devido a qualquer TEAE foi baixa (7,8%).1

† Conforme medido pela MADRS.
‡ Com base na incidência de sintomas de descontinuação (conforme medido pela escala DESS) e nas taxas de descontinuação devido a TEAEs.5,6
Abreviaturas:
MADRS, Escala de Avaliação de Depressão de Montgomery-Åsberg; TDM, Transtorno Depressivo Maior; EDM, Episódio Depressivo Maior; TEAE, Evento Adverso Emergente do Tratamento.
† Conforme medido pela MADRS.
‡ Com base na incidência de sintomas de descontinuação (conforme medido pela escala DESS) e nas taxas de descontinuação devido a TEAEs.5,6
Abreviaturas:
MADRS, Escala de Avaliação de Depressão de Montgomery-Åsberg; TDM, Transtorno Depressivo Maior; EDM, Episódio Depressivo Maior; TEAE, Evento Adverso Emergente do Tratamento.