Eficácia a longo prazo em trabalhadores ativos com transtorno depressivo maior
Em todo o mundo, o TDM tem um impacto considerável no local de trabalho.2 Pacientes com TDM geralmente apresentam funcionalidade comprometida, afetando especialmente a capacidade de trabalhar e produtividade.3-7 De fato, em comparação com a população em geral, pacientes com TDM apresentam aumento de absenteísmo8 e redução da produtividade no trabalho.9
Para reduzir o impacto do TDM no trabalho, as diretrizes atuais recomendam o tratamento a longo prazo de pelo menos seis meses após alcançar a remissão sintomática para pacientes que responderam ao tratamento agudo.10,11
Uma análise do estudo aberto AtWoRC (Avaliação da Produtividade no Trabalho e a Relação com Sintomas Cognitivos) avaliou os resultados do tratamento a longo prazo em pacientes com TDM que trabalham e foram tratados com Brintellix® 10-20 mg/dia ao longo de 52 semanas.†1
Após 52 semanas de tratamento com Brintellix® (10-20 mg/dia), 56% dos pacientes empregados alcançaram remissão e 77% dos pacientes alcançaram resposta ao tratamento.†1
Taxas de resposta ao tratamento e remissão após 52 semanas de tratamento com Brintellix®. †1
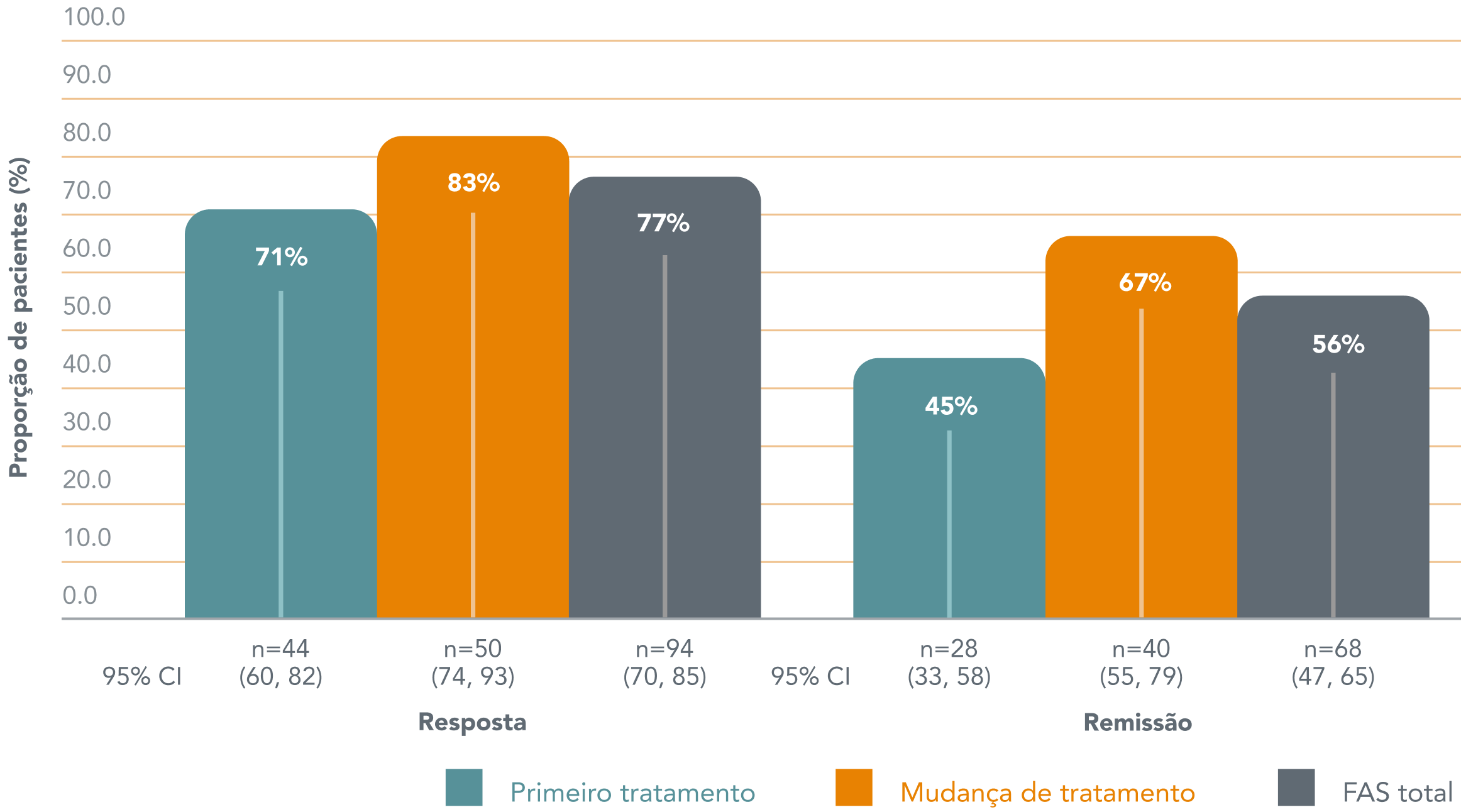
Adaptado de: Chokka P et al. 2019.
Entre os pacientes que tiveram uma resposta parcial ao tratamento anterior, 67% alcançaram remissão com Brintellix®† e 83% alcançaram resposta ao tratamento.1
Os sintomas cognitivos (PDQ-D-20) e a funcionalidade no local de trabalho (WLQ) melhoraram significativamente§ para os pacientes deste estudo, sendo encontrada uma correlação forte e altamente significativa entre os dois.¶1

Menos pacientes relataram dias de trabalho perdidos no último trimestre devido à depressão#1
Menos pacientes relataram dias de trabalho perdidos no último trimestre devido à depressão#1
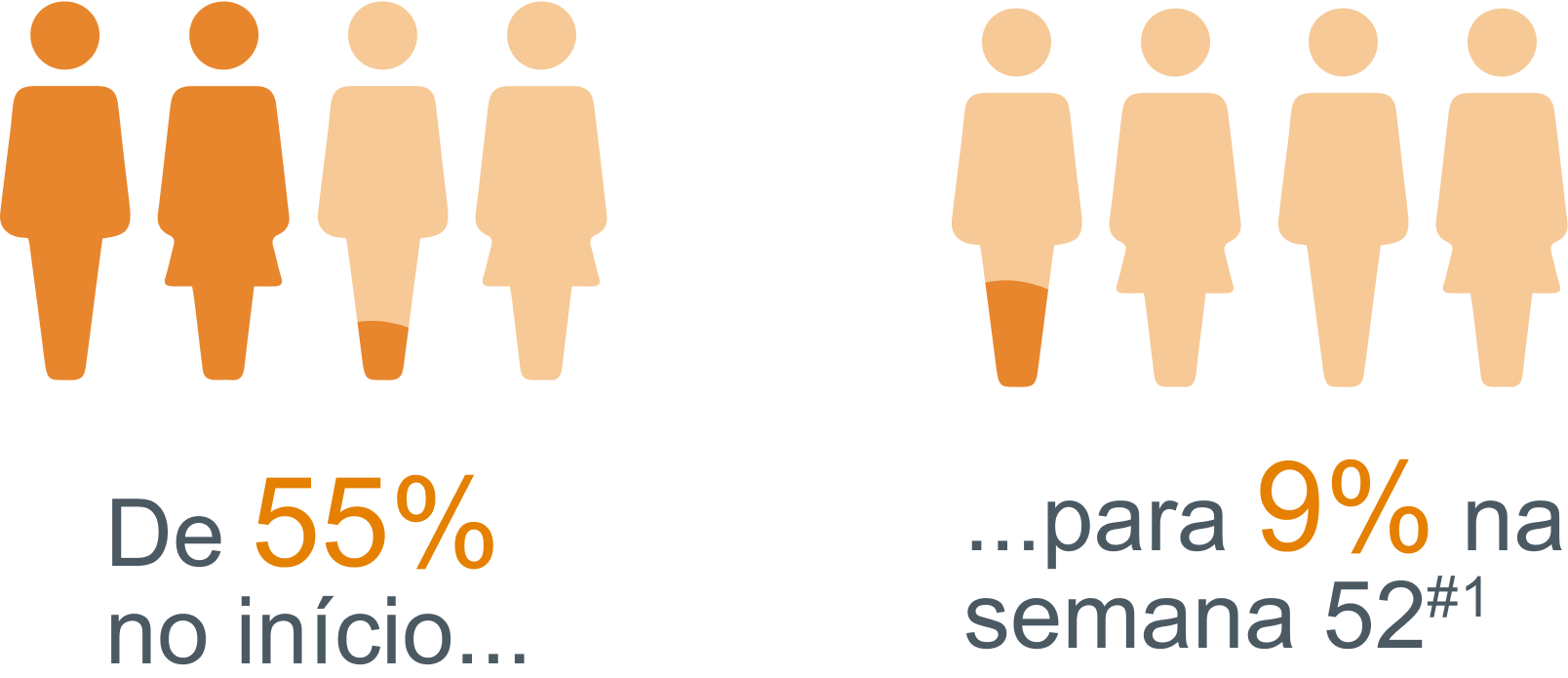
O estudo adicionalmente constatou que as melhorias nos sintomas depressivos (medidos pelo QIDS-SR) observadas a curto prazo também foram mantidas a longo prazo.§1
No geral, esses resultados demonstram os benefícios de longo prazo do tratamento com Brintellix® na prática clínica em pacientes com TDM que trabalham.1
O tratamento de longo prazo com Brintellix® geralmente foi bem tolerado e os eventos adversos mais comuns relacionados ao tratamento (TEAEs) foram náusea (29,2%), dor de cabeça (11,9%), insônia (9,1%), rinofaringite (6,8%), ansiedade (6,4%) e tontura (5,9%). Apenas alguns pacientes interromperam o tratamento devido a TEAEs (7,3%).1

* Paciente fictício
† Remissão definida como pontuação total do QIDS-SR ≤ 5. Resposta ao tratamento definida como mudança no QIDS-SR de ≥ 50% em relação ao valor inicial. Os pacientes foram estratificados se iniciaram com Brintellix® como o primeiro tratamento para o episódio depressivo atual ou se estavam trocando para o Brintellix® devido a uma resposta parcial ao antidepressivo prévio.1
# Casos observados na população.
§ As mudanças foram avaliadas a partir do valor inicial até a semana 12 (curto prazo) e a semana 52 (longo prazo), respectivamente. Mudança dos valores iniciaiss para a semana 52 na avaliação de pontuação de análise completa (casos observados), n = 199; perda de produtividade do WLQ -8.9, PDQ D-20 -30.4, QIDS-SR -12.2; todas as mudanças são p <0,001 em relação aos valores do início das avaliações.1
¶ Foi observada uma correlação forte e altamente significativa entre melhora dos sintomas cognitivos avaliados pelo paciente (PDQ D-20) e produtividade no trabalho (WLQ) (desfecho primário do estudo) na semana 12 (r = 0,606, p ≤ 0,001) e semana 52 (r = 0,665, p ≤ 0,001).1
Abreviaturas:
AtWoRC, avaliação da produtividade no trabalho e a relação com sintomas cognitivos; TDM, transtorno depressivo maior; PDQ-D-20, questionário de déficits percebidos de 20 itens - depressão; QIDS-SR, inventário rápido de sintomas depressivos - autorrelato; TEAE, evento adverso emergente do tratamento; WLQ, questionário de limitações no trabalho.
* Paciente fictício
† Remissão definida como pontuação total do QIDS-SR ≤ 5. Resposta ao tratamento definida como mudança no QIDS-SR de ≥ 50% em relação ao valor inicial. Os pacientes foram estratificados se iniciaram com Brintellix® como o primeiro tratamento para o episódio depressivo atual ou se estavam trocando para o Brintellix® devido a uma resposta parcial ao antidepressivo prévio.1
# Casos observados na população.
§ As mudanças foram avaliadas a partir do valor inicial até a semana 12 (curto prazo) e a semana 52 (longo prazo), respectivamente. Mudança dos valores iniciaiss para a semana 52 na avaliação de pontuação de análise completa (casos observados), n = 199; perda de produtividade do WLQ -8.9, PDQ D-20 -30.4, QIDS-SR -12.2; todas as mudanças são p <0,001 em relação aos valores do início das avaliações.1
¶ Foi observada uma correlação forte e altamente significativa entre melhora dos sintomas cognitivos avaliados pelo paciente (PDQ D-20) e produtividade no trabalho (WLQ) (desfecho primário do estudo) na semana 12 (r = 0,606, p ≤ 0,001) e semana 52 (r = 0,665, p ≤ 0,001).1
Abreviaturas:
AtWoRC, avaliação da produtividade no trabalho e a relação com sintomas cognitivos; TDM, transtorno depressivo maior; PDQ-D-20, questionário de déficits percebidos de 20 itens - depressão; QIDS-SR, inventário rápido de sintomas depressivos - autorrelato; TEAE, evento adverso emergente do tratamento; WLQ, questionário de limitações no trabalho.
Brintellix® é indicado para o tratamento do transtorno depressivo maior em adultos.