A neuroimagem por PET-tau na clínica é iminente e complementaria a PET-amiloide e a IRM estrutural e funcional em nossa busca por ferramentas no diagnóstico diferencial e no estadiamento das demências.
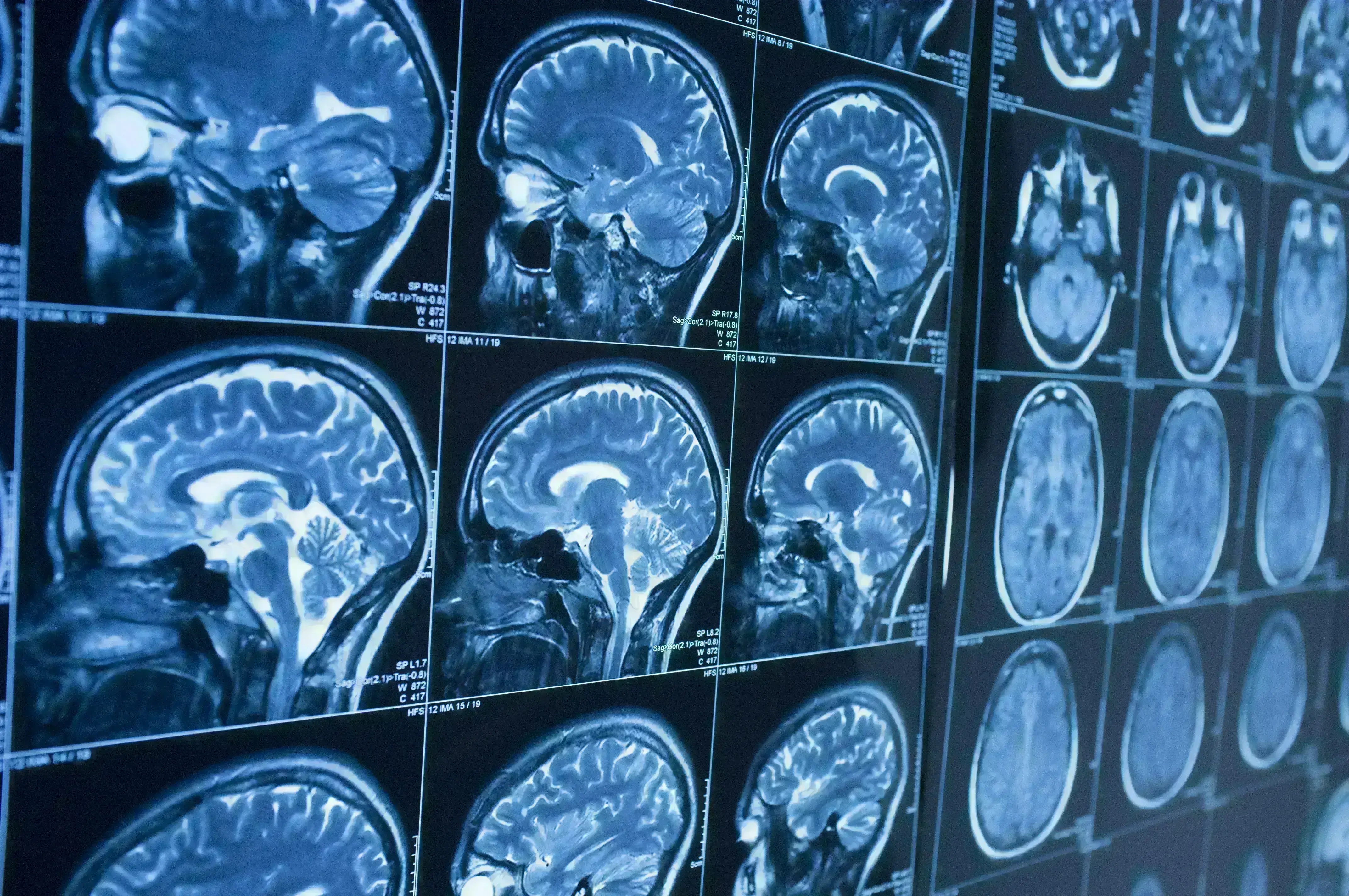
O aumento da gravidade da doença de Alzheimer (DA) está associado a uma quebra progressiva nas conexões anatômicas do cérebro, que pode ser revelada por imagem de ressonância magnética (IRM) funcional.1 Esse uso de imagem avançada para mapear alterações no conectoma cerebral estava entre as várias áreas de progresso apontadas por Massimo Filippi (Instituto Científico San Raffaele, Milão, Itália) na sessão do Congresso Virtual da Academia Europeia de Neurologia (EAN 2020), dedicado a novidades em neuroimagem.
O grupo de Milão já mostrou – em pessoas com um grau semelhante de comprometimento cognitivo – que a IRM funcional permite distinguir a DA de início precoce da variante comportamental da demência frontotemporal.2
Aumento da intensidade de campo da IRM melhora a detecção de placas amiloides
Em outros desenvolvimentos, o uso de IRM de ultra-alto campo agora demonstrou aumentar a detecção de placas amiloides que são evidentes post mortem. A capacidade de criação de imagens patológicas em alta resolução espacial pode oferecer um novo meio para a avaliação in vivo da carga amiloide em pacientes com DA.
Machine learning aplicado à IRM
O professor Filippi também chamou a atenção para o crescente papel da aprendizagem profunda (do inglês: deep learning), através da qual os sistemas de inteligência artificial comparam exames cerebrais a partir de indivíduos saudáveis e de pessoas com demência, para identificar padrões que refinam o diagnóstico e o prognóstico.3
Além do conhecimento existente sobre o valor prognóstico da IRM estrutural, um estudo da Iniciativa de Neuroimagem da Doença de Alzheimer (do inglês: Alzheimer’s Disease Neuroimaging Initiative - ADNI) mostra que a diminuição anual do volume prevê a conversão de comprometimento cognitivo leve para DA apenas quando o volume do início excede um determinado limite. Essa constatação possui implicações clínicas, mas também para o uso da taxa de atrofia como desfecho dos estudos.4
Tau como um fator da demência
Na mesma sessão, Alexander Drzezga (Universidade de Colônia, Alemanha) discutiu os avanços em neuroimagem de amiloide e de tau. Ele revisou evidências recentes de que uma maior carga amiloide em pessoas com declínio cognitivo subjetivo está associada a uma taxa mais rápida de deterioração em diversos domínios cognitivos5 – assim como é previsto a taxa de declínio em pessoas que já possuem comprometimento cognitivo objetivo.
A esperança é que a PET-tau revele a localização do desenvolvimento da atrofia, bem como a natureza da patologia
Contudo, o professor Drzezga observou que existe uma alta frequência de patologia amiloide relacionada à idade, independentemente do status cognitivo, e que muitos pacientes no estudo IDEAS (Demência por Imagem—Evidência para Varredura Amiloide - Imaging Dementia—Evidence for Amyloid Scanning), nos quais a DA está sendo considerada como um diagnóstico, não possuem amiloide na varredura por PET.6
Ele espera por uma época em que a PET-tau, embora atualmente ainda seja experimental, forneça informações clinicamente úteis sobre a localização da neurodegeneração e complemente as evidências da PET- amiloide sobre os processos neuropatológicos subjacentes à demência.
No estadiamento da doença, a tau pode ser mais útil do que a amiloide como um marcador, sugeriu ele, visto que o acúmulo de amiloide – que aparentemente se inicia muito mais cedo que o de tau – tende a atingir um platô antes do início da progressão clínica.
Our correspondent’s highlights from the symposium are meant as a fair representation of the scientific content presented. The views and opinions expressed on this page do not necessarily reflect those of Lundbeck.