O Projeto Human Connectome teve início em 2010, quando o National Institutes of Health (NIH) – um braço do Departamento de Saúde dos Estados Unidos (United States Department of Health & Human Services, HHS) – concedeu 40 milhões de dólares a dois consórcios para o desenvolvimento de métodos de neuroimagem de alta qualidade. O objetivo final é adquirir um conjunto de dados de tamanho e qualidade sem precedentes, com o intuito de mapear o cérebro humano em uma escala macroscópica.1 O projeto visa detalhar todas as conexões anatômicas e funcionais, de curta e longa distância, entre todas as áreas do cérebro. Consideradas as devidas proporções, assemelha-se ao Projeto Genoma, mas desta vez não se propõe a mapear o DNA humano, e sim o cérebro humano. O Human Connectome tem importantes implicações práticas, pois somente através de mapas detalhados das áreas do cérebro e de suas conexões poderemos compreender a função cerebral normal e, consequentemente, desvendar seus mistérios. Além disso, o mapeamento do cérebro “normal” expandirá a nossa capacidade de compreender e tratar distúrbios neurológicos e psiquiátricos.1,2 Para navegarmos nas áreas do cérebro, precisamos de mapas que nos guiem pelos seus infinitos caminhos e conexões.
Como o mapeamento do cérebro pode influenciar a prática clínica
Este texto tem como base a premissa de que o comportamento humano é a manifestação mais sensível do funcionamento cerebral.3 Dessa maneira, alterações do comportamento, tanto neurológicas como psiquiátricas (se é que essa divisão existe de fato), acontecem sob o pano de fundo de redes cerebrais anatômicas e funcionais que são responsáveis pelo processamento funcional alterado.4,5 Assim, alterações da memória recente, por exemplo, estão intrinsicamente ligadas à rede da memória episódica, tendo o hipocampo como seu componente central. Da mesma forma, distúrbios da linguagem, como as afasias, têm seus componentes centrais (áreas de Broca e de Wernicke) localizados no hemisfério esquerdo. Porém, transtornos comuns e frequentes na prática clínica, como a depressão, ainda são manejados sem a correlação neuroanatômica e funcional com regiões cerebrais fundamentais para o processamento emocional.4,5 Em paralelo com o Projeto Human Connectome, este artigo tenta fazer um mapeamento anatômico e funcional das regiões envolvidas na neurobiologia da depressão, com base nos dados disponíveis no momento.
“[...] alterações do comportamento, tanto neurológicas como psiquiátricas (se é que essa divisão existe de fato), acontecem sob o pano de fundo de redes cerebrais anatômicas e funcionais que são responsáveis pelo processamento funcional alterado.4,5”
Depressão: humor, cognição e controle vegetativo
Atualmente o diagnóstico de depressão é baseado na sintomatologia clínica, assim como a grande maioria dos distúrbios psiquiátricos, e não existe um marcador biológico específico e de uso clínico. De acordo com o DSM-5, a presença de humor deprimido e/ou anedonia (redução do interesse e da capacidade de experimentar prazer) são necessários para o diagnóstico.6 Porém, quando se analisam os demais critérios, fica claro que a depressão não engloba apenas sintomas relacionados ao humor. Sintomas vegetativos (alteração do apetite, sono, interesse sexual) e sintomas cognitivos (dificuldade de concentração, alentecimento ou agitação psicomotora, pensamentos de menos valia ou culpa) fazem parte da “síndrome depressiva”. Dessa forma, a neurobiologia da depressão envolve circuitos cerebrais relacionados não somente ao processamento emocional, mas também aos processamentos cognitivo e vegetativo.
Processamento emocional e córtex pré-frontal
Um conjunto amplo e convergente de informações localiza o processamento emocional no cérebro humano em uma série de regiões do córtex pré-frontal (CPF), principalmente as subdivisões ventromedial (CPFvm), ventrolateral (CPFvl), dorsomedial (CPFdm) e dorsolateral (CPFdl), cada uma com uma especialização funcional diferente.7-10 Destaca-se no CPFvm a porção subgeniculada do córtex do cíngulo anterior (CCAsg), região abaixo do joelho do corpo caloso. Essa região é intensamente conectada com regiões subcorticais e corticais e é o principal local eferente dos sistemas de regulação emocional (Figura 1).
Divisões anatômicas do córtex pré-frontal humano
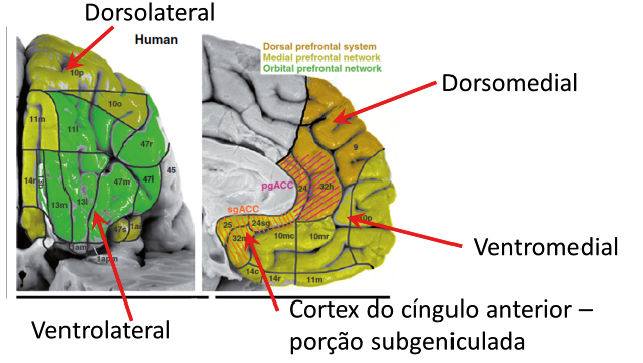
Adaptado da ref.8
Adaptado da ref.8
Esses estados de humor negativo são características fundamentais dos estados depressivos e são difíceis de ser modulados durante os episódios depressivos.6,10-13 Dessa maneira, as conexões diretas dessa região estariam desreguladas, como por exemplo o controle do hipotálamo, epicentro das alterações neuroendócrinas e vegetativas da depressão, e portanto do ciclo biológico (alterações de cortisol, do ritmo sono-vigília, apetite, desejo sexual etc.).
Além disso, regiões de regulação e controle executivo emocionais, como o CPFdl e o CPF dorsomedial (CPFdm, região importante na volição e na cognição social), ficariam com a eficiência reduzida, o que explicaria a grande dificuldade de racionalizar os pensamentos e emoções negativos (ruminações) nos estados depressivos. Um desequilíbrio entre porções emocionais (CPFvm e CPFvl) e cognitivas (CPFdl e CPFdm) tem sido relacionado à gênese e manutenção dos sintomas depressivos.11 Em linha com essa teoria, a disfunção cognitiva frequentemente encontrada na depressão (disfunção executiva e da atenção complexa) e as disfunções na volição (apatia, falta de energia) refletem, respectivamente, o mau funcionamento da porção dorsolateral e dorsomedial do CPF.
O córtex hipocampal, classicamente implicado na formação de memórias e parte integral do clássico circuito límbico de Papez,14 também está alterado na depressão. O volume dos hipocampos se mostrou inversamente proporcional ao número de episódios depressivos,15 apresentando inclusive alterações histológicas em sujeitos com depressão.16 Isso provavelmente ocorre, pois regiões do hipocampo têm neuroplasticidade e neurogênese constantes, sendo muito dependentes de fatores neurotróficos (frequentemente reduzidos na depressão) e sensíveis ao estresse e ao aumento do cortisol endógeno. A disfunção da formação hipocampal é responsável pelos achados de dificuldades de memória frequentemente vistos na síndrome depressiva,17 além de contribuir para a desregulação emocional encontrada na depressão. A figura 2 resume os achados aqui descritos e correlaciona as alterações clínicas com as alterações funcionais, com base na neuroanatomia proposta.
Diagrama ilustrando as conexões entre os sintomas clínicos e as regiões cerebrais envolvidas na neurobiologia da depressão
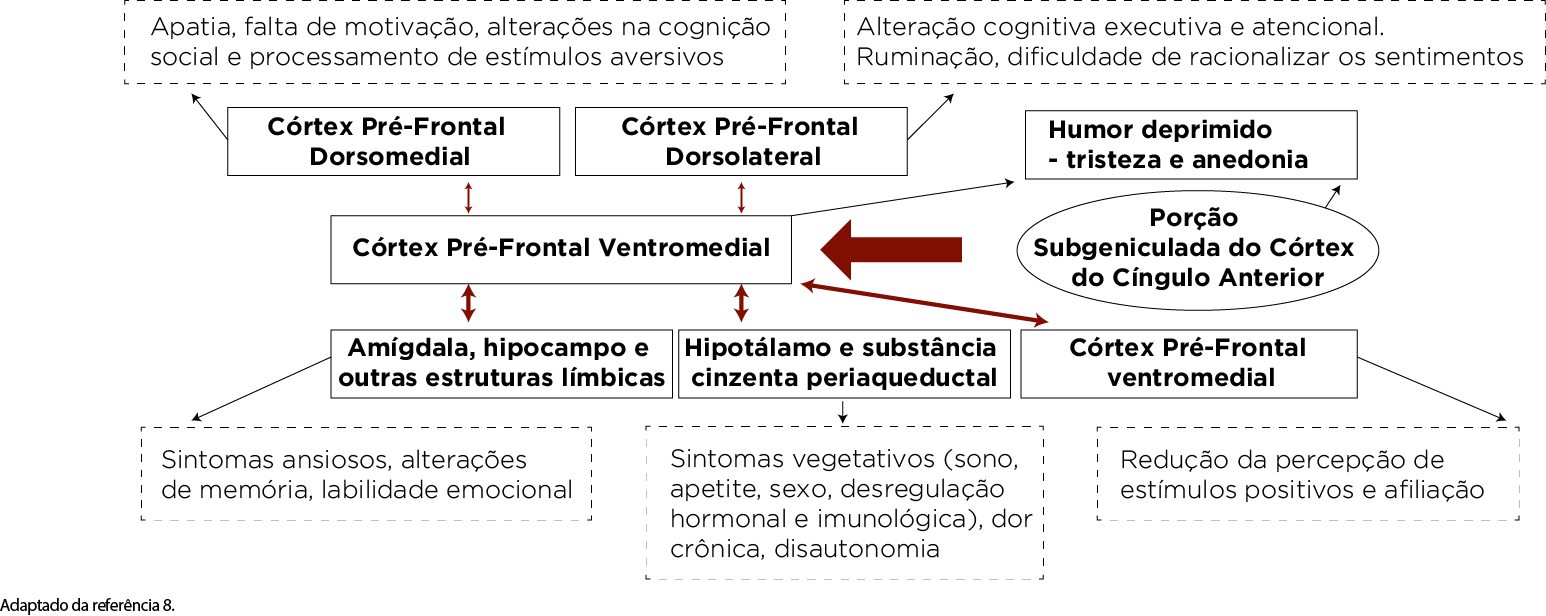
Adaptado da ref.8
Adaptado da ref.8
Conclusão
Em resumo, o entendimento do Projeto Human Connectome permite um paralelo com os avanços no entendimento da neurobiologia da depressão. O Human Connectome visa criar um mapa das conexões cerebrais em nível anatômico macroscópico (inicialmente) e microscópico (posteriormente),18 como um mapa de conectividade funcional.
Baseado na premissa de que o comportamento humano é reflexo do processamento cerebral, a teoria exposta aponta um modelo que tenta explicar os sintomas da síndrome depressiva com base nas regiões cerebrais envolvidas no processamento emocional, cognitivo e de controle vegetativo. Nesse modelo, regiões do CPFvm e do CPFvl, responsáveis pelo processamento emocional negativo, estariam disfuncionais, o que prejudicaria a adaptabilidade e o controle executivo das emoções negativas. Isso influenciaria todo o processamento emocional, causando a “contaminação” de áreas cerebrais não diretamente relacionadas ao processamento emocional com o teor negativo, de padrão mantido e não adaptável, provenientes do CPFvm e do CPFvl. O hipermetabolismo do CCAsg é uma das principais evidências de suporte dessa teoria. Esse modelo explica os sintomas de humor, vegetativos, neuroendócrinos e cognitivos encontrados na prática clínica em sujeitos com depressão e é baseado em uma série de estudos de neuroimagem estrutural ou funcional e histológicos.
Desafios para o futuro
Esse modelo teórico da depressão, além de explicar os sintomas clínicos, pode ser usado para o estudo de fatores de risco de depressão, como fatores genéticos e ambientais, além de explicar como diversos tratamentos, farmacológicos e não farmacológicos, agem para tratar os sintomas depressivos. Além de inovador, o modelo tem ganhado força no estudo do comportamento humano, considerando-se o acúmulo de evidências científicas encontradas em diversos centros espalhados pelo mundo. Esse modelo se mantém dentro do domínio da tradição médica, anatômica e fisiológica do comportamento humano.19 Portanto, navegar é preciso e descobrimentos são inevitáveis.